CAR-T細胞療法の開発の歴史と研究の進展
こんにちは。がん治療専門アドバイザー、本村ユウジです。
CAR-T細胞療法の研究開発は、1980年代から始まりました。当時、イスラエルのワイツマン研究所で研究を行っていたジーリグ・エシュハー博士は、T細胞ががん細胞をより正確に認識できるようにするため、がん抗原に結合する抗体の一部をT細胞受容体に組み込む方法を考案しました。
また、現在の藤田医科大学の黒澤良和博士らのグループが1987年に発表した「免疫グロブリンとT細胞受容体を組み合わせたキメラ受容体」も、CAR-T細胞療法の原型の一つとされています。
初期の研究では、抗原を認識する部分をT細胞に導入することには成功しましたが、それだけではがん細胞を十分に攻撃する力が得られませんでした。その後、T細胞の攻撃力を高める共刺激分子を追加するというアイデアが加わったことで、研究は大きく前進することになりました。
2007年、米国スローンケタリング記念がんセンターの免疫学者ミシェル・サダレイン博士が、B細胞のがんを標的とした臨床試験を開始しました。サダレイン博士は、T細胞の遺伝子を改変する技術を確立し、キメラ抗原受容体(CAR)に共刺激分子を組み込むことを考案しました。
当初、この臨床試験では患者を集めることが困難でした。人工的に改変したT細胞を患者の体内に戻すことに対して、多くの医師が懸念を示したためです。サダレイン博士自身も当時、「この治療法はサイエンス・フィクションのように思われるかもしれない」と述べるほど、画期的で未知の治療法でした。
最初の臨床試験の結果は2011年に発表されました。難治性の慢性リンパ性白血病と、再発した急性リンパ性白血病の患者9人にCAR-T細胞が投与され、投与したCAR-T細胞ががんに集まっていることが確認できました。
また、3人の患者には一定の治療効果が認められました。この成果を受けて、世界各地の医療機関で臨床試験が展開され、次々と画期的な治療成果が報告されることになりました。
CAR-T細胞療法の主な副作用とその管理
サイトカイン放出症候群という重要な副作用
CAR-T細胞療法の実用化に貢献したもう一人の重要な研究者が、ペンシルベニア大学のカール・ジューン教授です。
ジューン教授は1990年代、HIV(ヒト免疫不全ウイルス)の研究を通じてCAR技術に取り組むようになりました。妻を卵巣がんで亡くしたジューン教授は、がん研究に力を注ぎ、CAR技術を用いたがん治療の実現を2001年に目標として掲げました。
2010年、ジューン教授はB細胞のがん患者を対象とした臨床研究を開始しました。その後、ジューン教授らが開発したCAR-T細胞は「キムリア」として、世界で初めて承認されることになりました。
しかし、実用化に至るまでには大きな課題がありました。臨床試験の治療後に、不幸にも命を落とす患者さんが相次いだのです。これは主に「サイトカイン放出症候群」(cytokine release syndrome、CRS)と呼ばれる副作用が原因でした。
初期の臨床試験では、約3分の1近い患者さんが重い副作用に見舞われました。CAR-T細胞が体内に入ると免疫系が過剰に活性化され、正常な組織にまで攻撃が及んでしまったのです。その結果、高熱、筋肉痛、呼吸障害、低血圧、腎臓の機能障害など、全身にわたる症状が現れました。
副作用対策の進展:トシリズマブの発見
その後の研究により、炎症を引き起こす物質の一つである「インターロイキン6」(IL-6)を抑える薬「トシリズマブ」(商品名:アクテムラ)が、サイトカイン放出症候群に効果があることが明らかになりました。
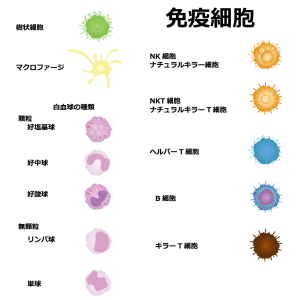
免疫が活発になった患者さんの体内では、マクロファージなどの免疫細胞の活動が高まります。IL-6はこれらの細胞によって産生され、過剰に分泌されると炎症を引き起こします。IL-6は免疫を調整する物質「サイトカイン」の一種です。
トシリズマブは、IL-6が過剰に働いている状態を抑える「抗IL-6抗体」薬です。IL-6の働きを抑えてもT細胞の機能には影響しないため、がんへの攻撃力が弱まることはありません。
2025年現在、サイトカイン放出症候群への対応は標準化されています。まず解熱薬(アセトアミノフェン)を投与し、改善が見られない場合は速やかにトシリズマブを使用します。早期にトシリズマブを投与することで、CAR-T細胞のがん攻撃効果を損なうことなく、重症化を防げることが示されています。特に高齢の患者さんでは、早めのタイミングでトシリズマブを使用することが推奨されています。それでも症状が改善しない場合は、副腎皮質ステロイドホルモンの投与が検討されます。
効果的な副作用対策が確立されたことが、CAR-T細胞療法の実用化を大きく後押ししたといえます。
サイトカイン放出症候群の症状と発現時期
サイトカイン放出症候群の初期症状には、発熱、悪寒、筋肉痛、頭痛、倦怠感などがあります。これらはインフルエンザに似た症状です。重症の場合は、低血圧、頻脈、呼吸困難などが現れ、これらの症状は急速に進行することがあります。
多くの場合、CAR-T細胞投与の翌日から14日目までに発生します。ただし、体内に残っているがんの量やCAR-T細胞の種類によって、発生するタイミングや程度は大きく異なることが知られています。
現在、各医療機関では看護師が患者さんの状態を注意深く観察する体制を整えています。しかし、サイトカイン放出症候群の程度や発生タイミングを正確に予測することは難しいため、患者さん自身が早期の症状を理解し、異常を感じたら速やかに医療スタッフに伝えることが重要です。
現在承認されているCAR-T細胞療法製剤
2025年現在、日本で承認されているCAR-T細胞療法製剤には以下のものがあります。
| 製品名(一般名) | 対象疾患 | 承認時期 |
|---|---|---|
| キムリア(チサゲンレクルユーセル) | 再発・難治性の急性リンパ性白血病(ALL)、びまん性大細胞型B細胞リンパ腫(DLBCL)、濾胞性リンパ腫 | 2019年承認 |
| イエスカルタ(アキシカブタゲンシロルユーセル) | 再発・難治性の大細胞型B細胞リンパ腫、初回治療後早期再発の大細胞型B細胞リンパ腫 | 日本で承認済み |
| ブレヤンジ(リソカブタゲンマラルユーセル) | 再発・難治性の大細胞型B細胞リンパ腫、初回治療後早期再発の大細胞型B細胞リンパ腫 | 日本で承認済み |
| アベクマ(イデカブタゲンビクルユーセル) | 再発・難治性の多発性骨髄腫 | 2022年日本承認 |
| カービクティ(シルタカブタゲンオートルユーセル) | 再発・難治性の多発性骨髄腫 | 日本で承認済み |
これらはすべて血液がんを対象とした治療法です。2025年の大きな変化として、かつては複数の治療後に行われていたCAR-T細胞療法が、初回治療後に再発した時点で実施できるようになったことが挙げられます。これにより、より早い段階で効果的な治療を受けられるようになりました。
CAR-T細胞療法の治療プロセスと費用
治療の流れ
CAR-T細胞療法は、主に以下のステップで行われます。
1. リンパ球採取(アフェレーシス):患者さんから血液を採取し、T細胞を含むリンパ球を分離します。この手技料は、製剤により14万4,800円から19万4,100円程度です。
2. CAR-T細胞の製造:採取した細胞は海外の製造施設に送られ、CAR遺伝子の導入と培養が行われます。製造には約4~6週間かかります。この間の運送費は薬価に含まれています。
3. ブリッジング療法:製造期間中(1~2ヶ月)、がんの進行を防ぐために通常の化学療法が行われることがあります。
4. 前処置:CAR-T細胞投与前に、抗がん剤(フルダラビンとシクロホスファミド)で体内のリンパ球を減らします。これにより、投与したCAR-T細胞が体内で増殖しやすくなります。
5. CAR-T細胞の投与:完成したCAR-T細胞を点滴で投与します。
6. 入院管理:投与後は約1ヶ月程度の入院が必要です。この期間、サイトカイン放出症候群や神経毒性などの副作用を慎重に観察します。
治療費用
CAR-T細胞療法の費用は高額です。投与時の医療費は平均で約3,660万円(範囲:3,500万円~4,370万円)となります。このうち、CAR-T細胞そのものの薬価が3,000万円を超えています。
患者さんの自己負担は、健康保険の2~3割負担で計算すると700万円~1,200万円程度になりますが、高額療養費制度を利用することで、実際の自己負担額は所得に応じた上限額までとなります。
ただし、入院期間が平均41日(範囲:23~98日)となるため、食事療養費や個室を希望した場合の差額ベッド代は別途必要になります。
CAR-T細胞療法が抱える課題と今後の対策
再発への対応
CAR-T細胞療法は「人工的に改変した細胞」を投与する治療であるため、長期にわたる経過観察が必要です。
いったん体内のがんが消える「寛解」の状態になっても、がんが再発してしまうケースがあります。再発の理由として考えられるのは、以下の2点です。
1. 患者さんの体内でCAR-T細胞の活動が弱まってしまうこと
2. がん細胞の表面にあったCD19抗原が消えてしまうこと
これらの問題に対して、CAR-T細胞の活動力が弱まらないようにする方法や、CD19以外の抗原を標的とする研究が進められています。
固形がんへの応用
現在、承認されているCAR-T細胞療法は血液がんに対するものだけですが、固形がんへの応用が大きな課題となっています。
固形がんでCAR-T細胞療法を実用化するには、重要な問題があります。まず、CAR-T細胞が結合する「がんに特有の抗原」を見つける必要があります。もし正常な細胞の表面にも同じ抗原があった場合、そこにもCAR-T細胞が結合して攻撃してしまうためです。
すでに承認されている製剤について説明すると、たとえばキムリアのターゲットはCD19抗原です。この抗原はB細胞の表面だけに存在しますが、がんになったB細胞だけでなく、正常なB細胞もCD19を持っています。キムリアを投与すると、がんになったB細胞も正常なB細胞も攻撃されます。
B細胞の役割は「免疫グロブリン」という抗体を作り出して、ウイルスなどの感染に対抗することです。この免疫グロブリンは薬で補充することが可能であり、そのため、CAR-T細胞がB細胞をすべて攻撃しても、患者さんは補充する薬を投与することで対応できています。
固形がんでは、このような対策が難しいことが課題となっています。
TCR-T細胞療法:新しい遺伝子改変T細胞療法
TCR-T細胞療法の仕組み
CAR-T細胞療法以外にも、T細胞に遺伝子改変を施した治療法として「TCR-T細胞療法」があります。
TCR-T細胞療法とは、がんを認識して攻撃モードに入ったT細胞のセンサー「T細胞受容体」(TCR)の遺伝子を、患者さんから採取したT細胞に導入し、患者さんに投与する治療法です。
患者さんの体内で戦闘モードのT細胞を育てるのではなく、すでに「がんとの戦い方を理解している」T細胞を体外で作成し、即戦力として体内に送り込むという仕組みです。
これまでに、悪性黒色腫(メラノーマ)や肉腫に対する臨床試験が実施され、一定の効果が確認されています。2024年8月には、アメリカで成人の滑膜肉腫に対するTCR-T細胞療法「TECELRA(アファミトレスゲンオートルーセル)」が世界で初めて承認されました。ただし、日本では2026年1月時点でまだ承認されていません。
CAR-T細胞療法とTCR-T細胞療法の違い
| 項目 | CAR-T細胞療法 | TCR-T細胞療法 |
|---|---|---|
| 標的とする抗原 | がん細胞表面の抗原のみ | 細胞表面と細胞内部の抗原 |
| 主な対象 | 血液がん(リンパ腫、白血病、多発性骨髄腫) | 固形がん(肉腫、メラノーマなど) |
| 承認状況(日本) | 5製品承認済み(2025年時点) | 未承認(臨床試験段階) |
| 特徴 | 特定のがんを攻撃するために人工的に設計 | 患者さん個人のがんに合わせて作成 |
CAR-T細胞はがん細胞の表面に出ている抗原しか認識できませんが、TCR-T細胞は細胞内部の特徴も認識できる可能性があります。このため、TCR-T細胞療法は固形がんに対する有効な治療法として期待されています。
一方で、TCR-T細胞はすでにがんを発症している患者さんの遺伝子を基に作られているため、特定のがんを攻撃するために人工的に設計したCAR-T細胞よりも効果が限定的になる可能性が指摘されています。
TCR-T細胞療法の開発状況
日本でも、国立がん研究センターや京都大学などでTCR-T細胞療法の研究が進められています。特に、患者さん一人ひとりが持つ「ネオアンチゲン」(がん細胞に特有の新しい抗原)に合わせたTCRの遺伝子を導入することで、個別化された治療を行う研究が進んでいます。
また、京都大学iPS細胞研究所が進める再生医療用iPS細胞バンクを利用して、患者さん個々のHLA型に適合したiPS細胞に、その人のがんに合わせたTCR遺伝子を導入する研究も行われています。このような個別化T細胞療法の実現に向けた取り組みが続けられています。
CAR-T細胞療法とTCR-T細胞療法の今後の展望
世界的な市場の成長
世界のCAR-T細胞療法市場は急速に拡大しています。2022年の19億米ドルから、2031年には59億米ドルに達すると予測されており、年平均成長率は13.5%と見込まれています。
この成長を支えているのは、血液がん患者数の増加と、従来の治療では効果が得られない患者さんへの新たな選択肢としての期待です。また、各国の規制当局による承認件数の増加や、製薬企業による研究開発投資の拡大も市場成長を後押ししています。
新しい適応疾患への展開
現在、CAR-T細胞療法とTCR-T細胞療法の開発は、がん以外の疾患にも広がっています。特に注目されているのは、自己免疫疾患(全身性エリテマトーデスや関節リウマチなど)への応用です。
自己免疫疾患では、抗体医薬品がすでに大きな市場を形成していますが、難治性の自己免疫疾患の切り札として、CAR-T細胞療法やTCR-T細胞療法の承認と普及拡大が期待されています。
製造技術の進化
現在のCAR-T細胞療法とTCR-T細胞療法は、患者さん自身のリンパ球を用いて遺伝子改変細胞を作るため、患者さんごとにすべての工程が必要となり、治療開始までに時間がかかるとともに高額な費用が必要です。
この課題を解決するため、遺伝子導入にウイルスを用いない方法や、あらかじめ準備した他人由来のリンパ球を使用する遺伝子改変細胞の開発が進められています。また、自動製造装置の導入により、製造コストの大幅な低減も期待されています。
日本における課題と展望
2026年現在、日本で保険適用されているCAR-T細胞療法製剤はすべて海外製です。薬価が超高額となるため、一般への普及には課題があります。海外の知的財産権に依存しない、日本独自の新技術開発とライセンス保護を国家レベルで進める必要性が指摘されています。
一方で、日本国内でもCAR-T細胞療法の実施施設は増加傾向にあり、2023年1月時点で43施設となっています。今後、医療体制の整備が進むことで、より多くの患者さんがこの治療を受けられるようになることが期待されます。
CAR-T細胞療法とTCR-T細胞療法は、従来の治療法では効果が得られなかった難治性がんに対する有力な選択肢として、今後も発展していくことが期待されています。
参考文献・出典情報
- 国立がん研究センター中央病院「CAR-T細胞療法のご案内」
- 日本造血・免疫細胞療法学会「CAR-T細胞療法の成績」
- 日本造血・免疫細胞療法学会「サイトカイン放出症候群(CRS)」
- 日本造血・免疫細胞療法学会「実際にかかる平均的な費用と概要」
- ヘルシスト「進化するがん免疫細胞療法 CAR-T/TCR-Tの期待と課題」(2025年1月10日発行)
- ケアネット「細胞免疫療法〜CAR T-cell・T-cell engager〜の進歩と今後の展望」(2025年3月)
- 京都大学「CAR-Tアフェレーシスの製剤間の相違を可視化」(2025年6月)
- ブリストル・マイヤーズ スクイブ「CAR T療法の総合情報サイト」
- 株式会社BBブリッジ「CAR-T/TCR-Tの開発・市場動向について調査結果を発表」(2024年12月)
- Panorama Data Insights「世界のCAR T細胞療法市場:2031年までに59億米ドルへ拡大」(2025年10月)