こんにちは。がん専門のアドバイザー、本村ユウジです。
肝臓がんの手術を受けることが決まった患者さんにとって、手術前にどのような検査が行われ、どのように手術内容が決まるのかを知ることは、治療への理解を深め、不安を和らげることにつながります。
この記事では、手術前に実施される検査の種類と目的、そして検査結果に基づいて切除範囲や術式がどのように決定されるのかについて、詳しく解説します。
肝臓がん手術前の検査の全体像
肝臓がんの手術が決まった段階で、医師は2つの重要な要素を詳しく調べる必要があります。1つ目は「がん(悪性腫瘍)の状態」、2つ目は「肝臓の機能」です。
これらの情報を総合的に評価することで、患者さんにとって最も安全で効果的な手術方針を決定します。手術前の検査は、単にがんの大きさや位置を確認するだけでなく、手術後の回復予測や合併症のリスク評価にも欠かせないプロセスです。
特に肝臓がんの患者さんの多くは、肝炎ウイルスの感染や肝硬変などによって肝臓の機能がすでに低下していることが多いため、どの程度の範囲を切除できるかは、残る肝臓の機能を慎重に見極めながら判断する必要があります。
腫瘍の状態を確認する検査
血液検査で調べる腫瘍マーカー
手術前の血液検査では、腫瘍マーカーとウイルスマーカーという2つのカテゴリーの項目を調べます。
腫瘍マーカーは、がんの存在や活動性を示す指標となる物質です。肝臓がんでは主に次のマーカーを測定します。
| 腫瘍マーカー | 特徴と役割 |
|---|---|
| AFP(アルファ胎児性たんぱく質) | 肝細胞がんで高値を示すことが多い基本的なマーカー。正常値は20ng/mL以下 |
| PIVKA-2 | 肝細胞がんに特異性が高く、AFPと組み合わせることで診断精度が向上する |
| AFPレクチン分画(AFP-L3) | AFPが高値の場合に、原因が肝細胞がんか肝硬変かを区別する補助的な検査 |
これらの腫瘍マーカーを手術前に測定しておく目的は、診断の補助だけではありません。手術後の経過観察においても、これらの値がどのように変化するかを追跡することで、再発の早期発見や治療効果の判定に役立てることができます。
たとえば、手術前に高値だった腫瘍マーカーが手術後に正常値まで下がり、その後再び上昇してきた場合は、再発の可能性を疑って追加の画像検査を行うといった対応が可能になります。
ウイルスマーカーの測定
日本における肝臓がんの多くは、B型肝炎ウイルス(HBV)やC型肝炎ウイルス(HCV)の慢性感染が背景にあります。ウイルスマーカーとして次の項目を検査します。
- HBs抗原:B型肝炎ウイルスの感染の有無を示す
- HBc抗体:過去または現在のB型肝炎ウイルス感染を示す
- HCV抗体:C型肝炎ウイルスの感染の有無を示す
ウイルス性肝炎から肝臓がんに進行した患者さんの場合、これまでの経過の中ですでにウイルス検査を受けていることがほとんどです。しかし、手術前に再度測定することで、現在のウイルスの活動状況を把握し、手術後の抗ウイルス療法の必要性や肝炎の悪化リスクを評価します。
画像診断による腫瘍の詳細な把握
肝臓内におけるがんの正確な位置、大きさ、数、周囲の血管との関係を立体的に把握するために、複数の画像診断を組み合わせて検査します。
手術前の画像診断で用いられる主な検査方法は次のとおりです。
- 超音波検査(エコー):リアルタイムで肝臓の状態を観察でき、繰り返し検査しやすい
- CT検査(コンピュータ断層撮影):造影剤を使用することで、がんと正常組織の区別が明瞭になる
- MRI検査(磁気共鳴画像):CTとは異なる原理で画像を作成し、小さな病変の検出に優れる
- 血管造影検査:肝動脈や門脈の走行とがんとの位置関係を詳しく調べる
近年では、造影剤を使用したダイナミックCTやEOB-MRI(肝細胞特異性造影剤を用いたMRI)など、より精密な検査が標準的に行われるようになっています。これらの検査により、直径1cm以下の小さながんも検出できるようになり、複数のがんが存在する場合の見逃しを減らすことが可能になっています。
画像診断で特に重要なのは、がんと血管の位置関係を事前に把握することです。肝臓には門脈、肝動脈、肝静脈という主要な血管が複雑に走行しており、がんがこれらの血管にどの程度近接しているか、あるいは浸潤しているかによって、切除の難易度や切除範囲が大きく変わってきます。
「自分の判断は正しいのか?」と不安な方へ

がん治療。
何を信じれば?
不安と恐怖で苦しい。
がん治療を左右するのは
治療法より“たった1つの条件”です。
まず、それを知ってください。
がん専門アドバイザー 本村ユウジ
肝機能の評価検査
肝臓がんの手術では、がんを確実に取り除くことと同時に、残った肝臓が手術後に十分機能できるかどうかを予測することが極めて重要です。そのため、手術前には詳細な肝機能評価を行います。
| 検査項目 | 評価内容 |
|---|---|
| 赤血球・白血球・血小板数 | 貧血の有無、感染への抵抗力、出血傾向や血栓リスクの評価 |
| AST、ALT | 肝細胞の障害の程度を示す。肝炎の活動性の指標となる |
| γ-GTP、ALP | 肝臓と胆道の機能を反映。胆汁の流れに異常がないかを確認 |
| 総たんぱく、アルブミン、コレステロール | 肝臓のたんぱく質合成能力を評価。栄養状態の把握にも重要 |
| 血糖値 | 糖代謝の状態を確認。肝臓の糖を処理する能力の指標 |
| PT(プロトロンビン時間)、ICG試験 | 凝固因子の合成能や肝臓の代謝・排泄能を直接評価する検査 |
| Child-Pugh分類 | 肝硬変の重症度を評価する総合的な指標(A、B、Cの3段階) |
これらの検査データを総合的に判断することで、患者さんがどの程度の範囲の肝切除に耐えられるかを予測します。
たとえば、肝機能が比較的良好なChild-Pugh分類Aの患者さんであれば、肝臓の約60〜70%を切除しても、残った肝臓が再生して機能を維持できる可能性があります。一方、肝硬変が進行してChild-Pugh分類Bの患者さんでは、切除できる範囲が30%程度に制限されることもあります。
ICG試験(インドシアニングリーン試験)は、肝臓の色素排泄能を調べる検査で、15分後の血中残存率(ICG-R15)が重要な指標となります。この値が低いほど肝機能が良好であることを示し、安全に切除できる肝臓の容積を計算する際に用いられます。
切除範囲の決定プロセス
肝臓がんの手術では、がんを確実に取り除くために周辺の組織も含めて切除することが理想です。しかし、肝臓がんの患者さんの多くは肝硬変などで肝機能が低下しているため、切除範囲を広くしすぎると手術後の肝不全のリスクが高まります。
この相反する要求をバランスよく満たすため、切除範囲の決定には執刀医の豊富な経験と慎重な判断が求められます。手術前には、外科医、画像診断医、肝臓内科医などが参加するカンファレンス(検討会)で、個々の患者さんに最適な手術方針を検討します。
腫瘍の状態に基づく切除範囲の設定
切除範囲は、主に次の3つの要素によって決定されます。
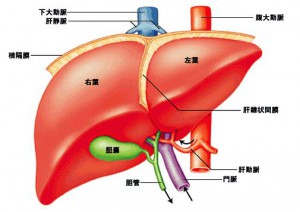
1つ目は、腫瘍の位置です。肝臓は門脈の分岐に基づいて8つの区域(亜区域)に分けられており、がんがどの区域に存在するかが切除範囲の基本となります。
門脈は肝門部から肝臓に入ると、まず右枝と左枝に分かれて右葉と左葉に分かれます。さらに細かく分岐して、肝臓全体を8つの区域に分けています。がんが門脈の末梢(先端)にある場合は、その区域のみの切除で済むことがあります。
しかし、がんが門脈の中枢側(肝門部に近い側)にある場合は、がん細胞が血流に乗って他の区域に広がっている可能性を考慮し、複数の区域を切除する必要があります。
2つ目は、腫瘍の大きさと数です。単発で小さながんであれば、その部分だけを限局的に切除する「部分切除」や「亜区域切除」が選択されます。一方、がんが大きい場合や複数ある場合は、より広い範囲の「区域切除」や「葉切除」が必要になることがあります。
3つ目は、肝内転移の有無です。肝臓がんは門脈系を通じて肝臓内に広がりやすい性質があります。画像診断で明らかな肝内転移が確認された場合は、それらも含めて切除範囲を設定します。
血管との位置関係による切除方法の調整
肝臓には太い血管が複雑に走行しているため、がんと血管の位置関係は切除範囲の決定に大きく影響します。
がんが主要な血管の近くにある場合、理想的には血管の分岐を考慮して予防的に広い範囲を切除したいところですが、それによって切除範囲が過度に大きくなってしまう場合は、腫瘍部分のみを慎重に切除し、周辺の予防的切除は最小限にとどめることもあります。
特に肝静脈や門脈の主要な分岐部近くにがんがある場合は、手術の難易度が高くなり、血管の合併切除や再建が必要になることもあります。
肝機能から予測される切除後の状態
どれだけの範囲を切除できるかは、術前の肝機能評価に加えて、切除によってどれだけの肝組織が失われるかを正確に計算することで判断します。
がんが肝臓の表面近くにある場合は、腫瘍周囲の正常肝組織をほとんど犠牲にせずに切除できるため、肝機能に余裕がない患者さんでも手術が可能です。
一方、がんが肝臓の深部にある場合は、そこに到達するために周囲の正常肝組織をある程度切除せざるを得ないため、より良好な肝機能が必要になります。
近年では、CTやMRIの画像データをコンピュータで解析し、予定している切除範囲が肝臓全体の何パーセントに相当するかを三次元的に計算することが可能になっています。この計算結果と術前の肝機能データを組み合わせることで、手術後の残肝機能を予測し、肝不全のリスクを最小限に抑える手術計画を立てます。
がんの種類による切除範囲の違い
肝臓に発生するがんには、大きく分けて「肝細胞がん」と「肝内胆管がん」があり、それぞれ広がり方の特徴が異なるため、切除範囲の設定も変わってきます。
肝細胞がんの場合
肝細胞がんは門脈系を通じて広がる傾向があるため、門脈の分岐に基づいた区域切除が基本となります。がんが1つの区域内に限局している場合は、その区域の切除で対応できることが多いです。
肝内胆管がんの場合
肝内胆管がんは、胆管に沿って進展する性質があります。そのため、肝細胞がんで1つの区域切除で済む場合でも、肝内胆管がんではさらに広い範囲、具体的には胆管に沿った方向に切除範囲を拡大する必要があります。
また、肝内胆管がんは周囲のリンパ節に転移しやすい特徴があるため、肝臓の切除に加えて「リンパ節郭清」(がんの周囲のリンパ節を切除する手術)も同時に行います。肝門部周囲のリンパ節を中心に、系統的に郭清することで、転移の可能性を減らします。
術式の最終決定
以上のような多角的な評価を経て、最終的な術式が決定されます。代表的な術式には次のようなものがあります。
- 部分切除:腫瘍とその周囲の一部のみを切除する
- 亜区域切除:1つまたは複数の亜区域を切除する
- 区域切除:解剖学的な区域単位で切除する
- 葉切除:右葉または左葉を切除する
- 拡大葉切除:葉切除に加えて対側の一部も切除する
手術方針の決定では、がんを確実に取り除くことと、患者さんの安全を守ることのバランスが最も重要です。そのため、術前の詳細な検査と慎重な評価が、手術の成功に直結する重要なプロセスとなります。
参考文献・出典情報
- 国立がん研究センターがん情報サービス「肝細胞がん」
https://ganjoho.jp/public/cancer/liver/index.html - 日本肝臓学会「肝癌診療ガイドライン」
https://www.jsh.or.jp/medical/guidelines/jsh_guidlines/hepatoma - 日本肝胆膵外科学会「肝切除術」
https://www.jshbps.jp/modules/public/index.php?content_id=11 - 国立がん研究センター中央病院「肝臓がんの診断」
https://www.ncc.go.jp/jp/ncch/division/gastro_surgery/040/index.html - 厚生労働省「肝炎総合対策の推進」
https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/kenkou_iryou/kenkou/kekkaku-kansenshou09/index.html - 日本消化器病学会「肝疾患診療マニュアル」
https://www.jsge.or.jp/guideline/guideline - 日本癌治療学会「がん診療ガイドライン」
https://www.jsco-cpg.jp/ - 国立国際医療研究センター肝炎情報センター「肝炎の病態と診断」
http://www.kanen.ncgm.go.jp/ - 日本臨床腫瘍学会「腫瘍マーカーの適正使用」
https://www.jsmo.or.jp/ - 日本医学放射線学会「肝臓の画像診断」
https://www.radiology.jp/



